مرور اجمالی بر کاربردهای اسید فسفریک و عوامل اتصال فسفاتی
این مقاله در مجله صنعت نسوز، شماره هشتم، تابستان ۱۳۹۶، از صفحه ۴۶ تا صفحه ۴۹ به چاپ رسیده است.
نویسندگان:
محسن امین، مدیر سابق طراحی محصول و کنترل کیفیت – شرکت دانش بنیان گروه پاترون
حسن بداغی، مدیر تحقیق و توسعه – شرکت دانش بنیان گروه پاترون
محمدحمید وکیل نژاد، کارشناس سابق تحقیق و توسعه – شرکت دانش بنیان گروه پاترون و کارشناس ارشد مهندسی نانوفناوری – نانومواد دانشگاه علم و صنعت ایران
جهت دریافت فایل پی دی اف این مقاله لطفا اینجا را کلیک بفرمایید.
۱- مقدمه
اگرچه اسید فسفریک (H3PO4) به تنهایی دارای خواص چسبندگی نیست، ولی در واکنش با اکسیدهای فلزی، نمکهایی را تشکیل میدهد که خود به عنوان اتصالدهنده عمل میکنند. دیرگدازهایی که در آنها از چسبهای فسفاتی استفاده میشود به عنوان ” دیرگدازهای اتصال فسفاتی[۱] ” شناخته میشوند.
به طورکلی، یون (PO4)3- در H3PO4 بهعنوان رادیکال اسیدی شناخته میشود. اسید فسفریک و دیگر فسفاتها در برگیرنده رادیکالهای دیگری مانند (P2O7)4- ، (PnO3n+1)(n+2)- ، (PO3)– هستند.
۲- تعریف اسید فسفریک
اسید فسفریک به نامهای مختلف وجود دارد که در جدول۱ نشان داده شده است. اما استفاده از اسید ارتوفسفریک یا H3PO4 عمومیت بیشتری دارد. بنابراین عموماً در به کار بردن نام اسید فسفریک منظور اسید ارتوفسفریک یا H3PO4 میباشد.
[۱] Phosphate-Bonded Refractories
|
جدول۱- انواع اسید فسفریک و خواص آنها |
||
|
نام |
فرمول شیمیایی |
خواص |
|
اسید هیپو فسفری |
H3PO2 |
دمای ذوب oC27، کریستال بیرنگ |
|
اسید فسفری |
H3PO3 |
دمای ذوب oC72 ، کریستال بیرنگ |
|
اسید هیپو فسفریک |
H4P2O6 |
اسید چهار ظرفیتی |
|
اسید متافسفریک |
(HPO3)n |
بیرنگ و شیشهای |
|
اسید پیروفسفریک |
H4P2O7 |
دمای ذوب oC61، بیرنگ، کریستالهای سوزنی شکل یا شیشهای جامد |
|
اسید ارتوفسفریک |
H3PO4 |
دمای ذوب oC43، بیرنگ، کریستال شفاف |
۳- خواص مهم اسید فسفریک
اسید فسفریک خالص دارای دانسیته ۱٫۸۸ g/cm3 است. اسید فسفریک در بازار به صورت محلول آبی۵۰ تا ۸۵ درصد به فروش میرسد. هر کدام از این نوع اسید فسفریکها خواص منحصر به فرد خود را دارند. به عنوان مثال اسید فسفریک ۸۵ درصد دارای نقطه ذوب oC21 و چگالی ۱٫۶۸ g/cm3 میباشد و مقدار P2O5 در آن در حدود ۶۲درصد است، در حالیکه اسید فسفریک ۸۰ درصد، نقطه ذوب oC5، چگالی ۱٫۶۳ g/cm3 و درصد P2O5 در آن ۵۸درصد است.
۴- واکنش میان اسید فسفریک و اکسیدها یا هیدروکسیدها
اسید فسفریک با اکسیدها یا هیدروکسیدها واکنش میکند و با تشکیل نمک باعث ایجاد اتصال در دیرگدازها میگردد. اسید فسفریک و هیدروکسید آلومینیوم Al(OH)3 در دمای اتاق واکنش میدهند و تشکیل نمک میدهند ولی واکنش میان اسید فسفریک و آلومینا در دمای اتاق به آهستگی اتفاق میافتد و برای تکمیل واکنش باید دما افزایش یابد. بنابراین هنگامی که دما افزایش مییابد، اسید فسفریک دیهیدراته شده و با آلومینا واکنش میدهد تا مونوآلومینیوم فسفات[۱] تشکیل میگردد:
Al2O3+3H3PO4= 2Al(H2PO4)3+3H2O
این واکنش در دمای بالای oC۱۲۷ شروع گردیده و تا دمای oC۴۲۷ ادامه مییابد. در دمای بین oC۷۳۲ تا oC۱۳۲۷، ارتو آلومینیوم فسفات یا AlPO4 شکل میگیرد. بنابراین در دیرگدازهای آلومینایی این واکنش اتفاق میافتد و باعث ایجاد پیوند خواهد شد.
۵- نقش اسید فسفریک در دیرگدازهای آلومینوسیلیکاتی
در دیرگدازهای آلومینوسیلیکاتی که در بردارنده SiO2 میباشد، در دماهای اولیه سیلیس با اسید فسفریک واکنش نمیکند و تنها Al(H2PO4)3 تشکیل میگردد. ولی در دمای بین oC۱۱۰۰ تا oC۱۳۰۰ ترکیباتی مانند SiO2.P2O5 و ۲SiO2.P2O5 به همراه فاز مایع تشکیل میگردد. بنابراین ترکیبات SiO2-P2O5 به دلیل نسوزندگی پایین برای مواد دیرگداز مناسب نیستند که در شکل ۱ نشان داده شده است:
[۱] MAP = Al(H2PO4)3
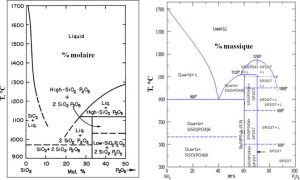
شکل۱- ترکیبات با نقطه ذوب پایین ناشی از واکنش SiO2 و P2O5
۶- واکنش اسید فسفریک با اکسیدمنیزیم یا هیدروکسیدمنیزیم
اسید فسفریک به سرعت با هیدروکسید منیزیم و اکسیدمنیزیم (منیزیا) واکنش میکند و تشکیل Mg(H2PO3)2 میدهد، ولی پیوندزایی آن ضعیف است. همچنین اسید فسفریک با منیزیا تشکیل فازهای دما پایین میدهد که باعث افت خواص نسوزندگی همانند استحکام خمشی گرم میگردد که در شکل ۲ نشان داده شده است.
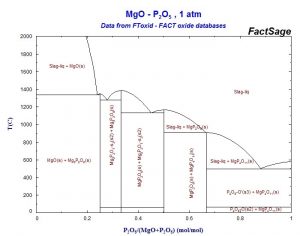
شکل۲- دیاگرام دوتایی MgO-P2O5
۷- فسفات آلومینیوم
ترکیب شیمیایی فسفات آلومینیوم بسیار پیچیده است و بسیاری از آنها هنوز ناشناخته اند. مهمترین ترکیب فسفات آلومینیوم که بیشترین کاربرد را در تولید فرآوردههای دیرگداز دارد ” مونوآلومینیوم فسفات ” یا به اختصار MAP با فرمول شیمیایی Al(H2PO4)3 است. دلیل استفاده بیشتر از MAP در میان دیگر ترکیبات فسفات آلومینیوم، انحلالپذیری بیشتر در آب، استحکام اتصال بالا و پایداری مناسب آن میباشد.
۱-۷- تولید مونوآلومینوم فسفات (MAP)
مونو آلومینیوم فسفات از طریق واکنش بین اسید فسفریک و هیدروکسیدآلومینیوم در دمای بین oC۱۰۰ تا oC۲۰۰ به دست میآید:
Al(OH)3+3H3PO4= Al(H2PO4)3+3H2O
در واقعیت تولید مونوآلومینیوم فسفات به صورت استوکیومتری که نسبت مولی دقیق Al2O3/P2O5=0.33 داشته باشد، دشوار است. نسبت مولی واقعی محصول تولید شده مونوآلومینیوم فسفات بین۰٫۳ تا ۰٫۳۵ میباشد. محصول تولیدی مونوآلومینیوم فسفات میتواند توسط اسپری درایر خشک گردیده و به صورت پودر حاصل گردد، که بلافاصله هنگامی که در تماس با آب قرار میگیرد به دلیل خاصیت آب دوستی، به صورت محلول در میآید.
۲-۷- خواص مونوآلومینیوم فسفات
ماهیت محلول مونو آلومینیوم فسفات اسیدی است و pH آن در حدود ۱٫۴ است. مونوآلومینیوم فسفات در دمای اتاق به سرعت سخت نمیشود و زمانی که حرارت میبیند در دمای حدود oC۱۰۰، بخشی از آب ساختاری خود را از دست داده و سخت میگردد. اما این اتصال زمانی که در تماس با هوا قرار میگیرد افت میکند، زیرا رطوبت هوا را مجدداً جذب کرده و استحکام کاهش مییابد. برای اینکه از این اتفاق جلوگیری گردد، دیرگدازی که اتصال آن مونوآلومینیوم فسفات است را باید تا دمای بالای oC۳۵۰ حرارت داد. زیرا در بالای oC۳۵۰، خاصیت آب دوستی خود را از دست داده و استحکام آن افت نخواهد کرد.
یکی از راههایی که میتوان سرعت واکنش مونوآلومینیوم فسفات در دمای پایین را تشدید کرد استفاده از عامل گیرشکننده است که معمولاً این عامل منیزیا (MgO) است. واکنش بین مونوآلومینیوم فسفات و منیزیا گرمازا است. این واکنش به نسبت مولی P/(Al+Mg) بستگی دارد:
الف ) اگر نسبت مولی P/(Al+Mg) برابر ۱ باشد :
در دماهای پایین محصول واکنش MgHPO4.3H2O خواهد بود و در ادامه با افزایش دما واکنش های زیر اتفاق خواهد افتاد:
Al(H2PO4)3+MgO= AlPO4.mH2O+ MgHPO4.3H2O+ [AlH3(PO4)2.3H2O]
at 150 – ۲۰۰۰c= AlPO4(Tri)+ فسفات منیزیم آمورف at 650 0c = AlPO4(Tri)+ Mg2P2O7
at 900-10000c = AlPO4(Cri)+ Mg3(PO4)2
ب ) اگر نسبت مولی P/(Al+Mg) برابر ۱٫۵ باشد :
- Ber= Berlinite
- Tri= Tridymite
- Cri=Cristobalite
چنانچه در واکنشهای بالا نشان داده شده است، منیزیا باعث تشکیل فازهای به نقطه ذوب پایین مثل Mg3(PO4)2 با نقطه ذوب oC۱۳۵۷ و Mg(PO3)2 با نقطه ذوب oC۱۱۶۵ میگردد که باعث افت خواص دمای بالای دیرگدازهای حاوی مونوآلومینیوم فسفات میگردد. همچنین منیزیا باعث شکستن اتصالات سهبعدی مونوآلومینیوم فسفات میگردد. در نتیجه هرچند در دمای پایین این ماده به عنوان عامل گیرشکننده و افزایشدهنده سرعت واکنش عمل میکند ولی در دماهای بالا باعث افت نسوزندگی خواهد شد.
منابع:
[۱] Hand book of refractory practice 2005 / published by Harbison – walker Refractories Company.
[۲] Technology of monolithic refractories published and distributioned by Plibrico Japan Company.